スマホで化学!
高校化学を見やすく, 詳しく解説
最外殻電子と価電子
- 例題1
次の(a)〜(c)の原子の最外殻電子はいくつか。
(a) O(原子番号:8) (b) Ne(原子番号:10)
(c) Si(原子番号:14)
(a) O(原子番号:8) (b) Ne(原子番号:10)
(c) Si(原子番号:14)
- (a)6個 (b)8個 (c)4個
最外殻電子
最外殻電子とは、一番外側の電子殻にある電子のことです。なので、電子配置の図が描ければ簡単です。(電子配置がわからない人はこちら)解説:
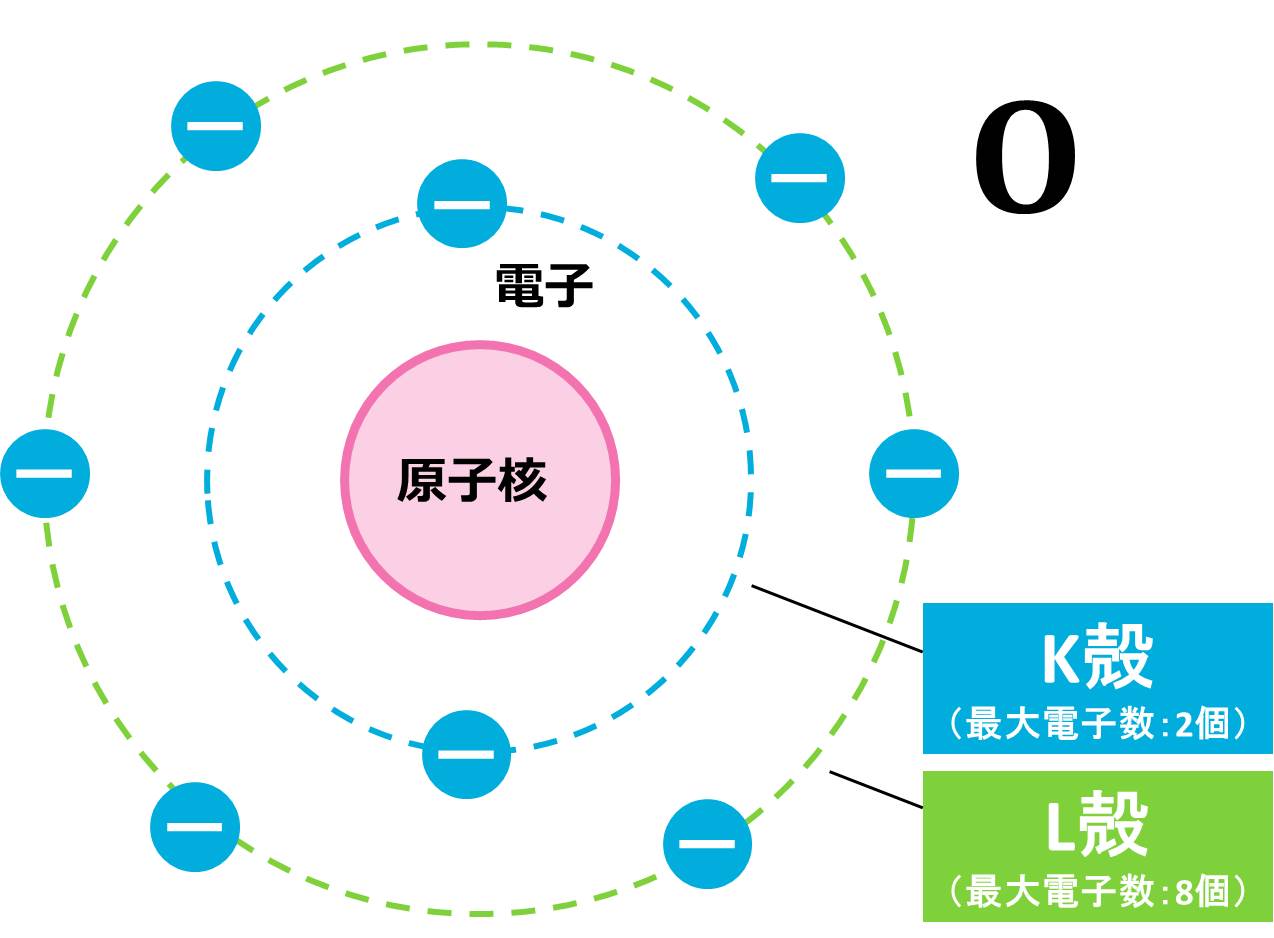
(a) O(酸素)原子は原子番号が8なので、電子の数は8個です(電子の数=原子番号)。まずは、電子配置を求めましょう。K殻は最大電子数が2個なので、酸素原子が持つ8個の電子のうち、2個がK殻に配置されます。残りの電子は6個ですが、L殻の最大電子数は8個なので、残りはすべてL殻に収まりそうです。
この配置を図で表すと下の図のようになります。O原子の場合、一番外側にあるのはL殻で、ここには6個の電子がありますので、最外殻電子は6個となります。
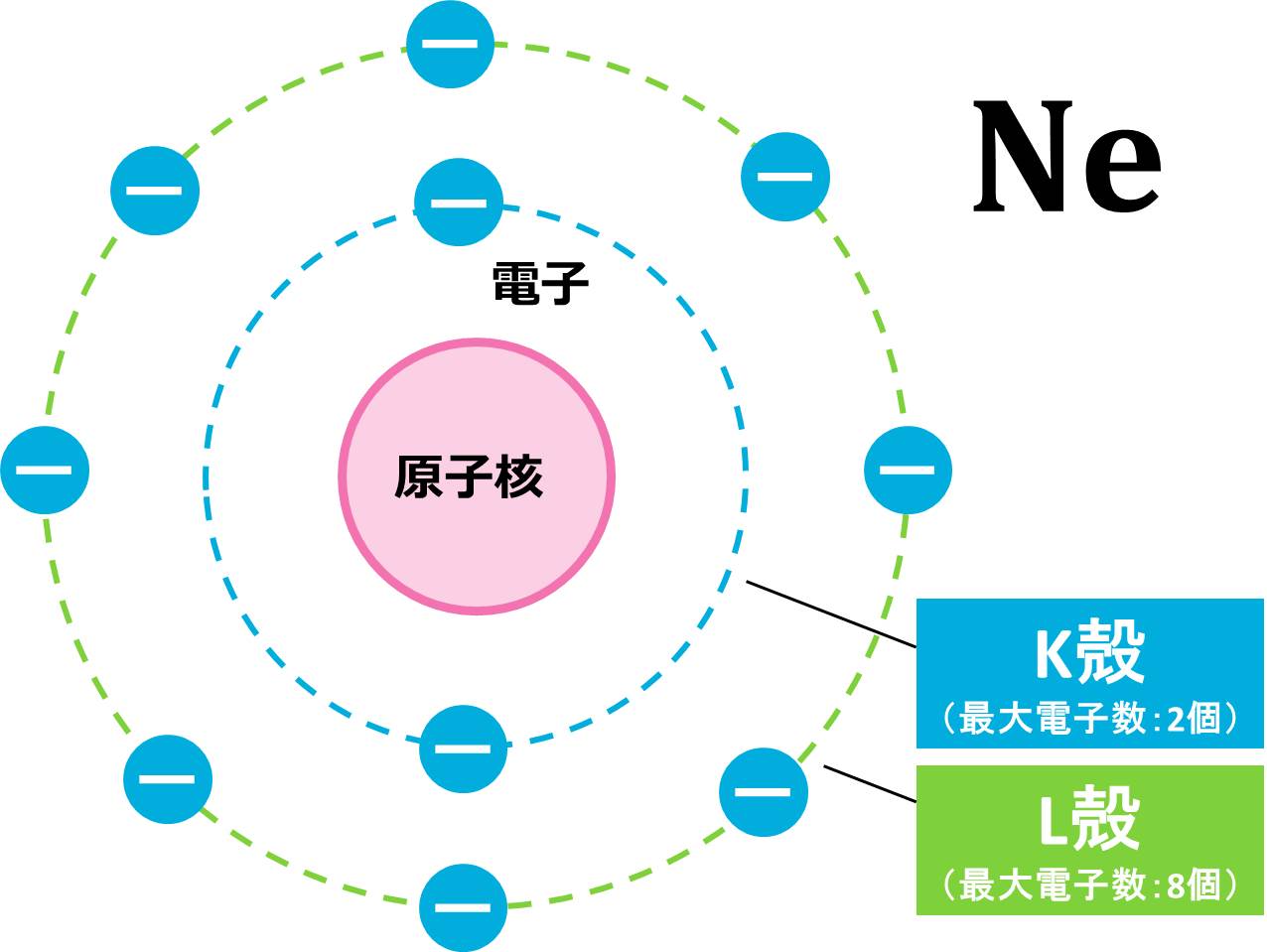
(b) 電子の数=原子番号なので、Ne(ネオン)原子の電子数は10個です。まずは、電子配置を求めましょう。
K殻は最大電子数が2個なので、Ne原子が持つ10個の電子のうち、2個がK殻に配置されます。残りの電子は8個ですが、L殻の最大電子数は8個なので、残りはL殻にピッタリ収まりそうです。
この配置を図で表すと下の図のようになります。Ne原子の場合、一番外側にあるのはL殻で、ここには8個の電子がありますので、最外殻電子は8個となります。
(c) 電子の数=原子番号なので、Si(ケイ素)原子の電子数は14個です。まずは、電子配置を求めましょう。
K殻は最大電子数が2個なので、Si原子が持つ14個の電子のうち、2個がK殻に配置されます。残りの電子は12個ですが、L殻の最大電子数は8個なので、8個がL殻に入ったあとに4個余ります。この4個の電子はM殻に入ります。
この配置を図で表すと下の図のようになります。Si原子の場合、一番外側にあるのはM殻で、ここには4個の電子がありますので、最外殻電子は4個となります。
