スマホで化学!
高校化学を見やすく, 詳しく解説
電子配置
- 例題1
次の(a)〜(c)の原子の電子配置を下に示した[例]のような形で表せ。
[例] F(原子番号:9) ⇒ F=K(2)L(7)
(a) C(原子番号:6) (b) Ne(原子番号:10)
(c) Al(原子番号:13)
[例] F(原子番号:9) ⇒ F=K(2)L(7)
(a) C(原子番号:6) (b) Ne(原子番号:10)
(c) Al(原子番号:13)
- (a)C=K(2)L(4) (b)Ne=K(2)L(8) (c)Al=K(2)L(8)M(3)
電子配置のやり方
これは、電子配置を求める問題です。今までの問題で、電子は原子核の周りをまわっていることを学んできました。ただし、まわっていると言っても、全ての電子が同じコースをまわっているわけではなく、コースがいくつかあり、「このコースには電子が何個までまわれる」という電子の配置が決まっています。電子が原子核の周りをまわるコースを電子殻といい、内側から順にK殻、L殻、M殻、N殻、・・・と、Kから始まるアルファベット順に名前があります。そして、1番目のK殻は2個、2番目のM殻は8個、3番目のL殻は18個までというように、入ることのできる電子の数に制限があり、内側の電子殻から順に電子が配置されていきます。
この数字は覚えなくても、「n番目の電子殻には2n2個まで」という公式のnに数字を代入すれば求められます。

解説:
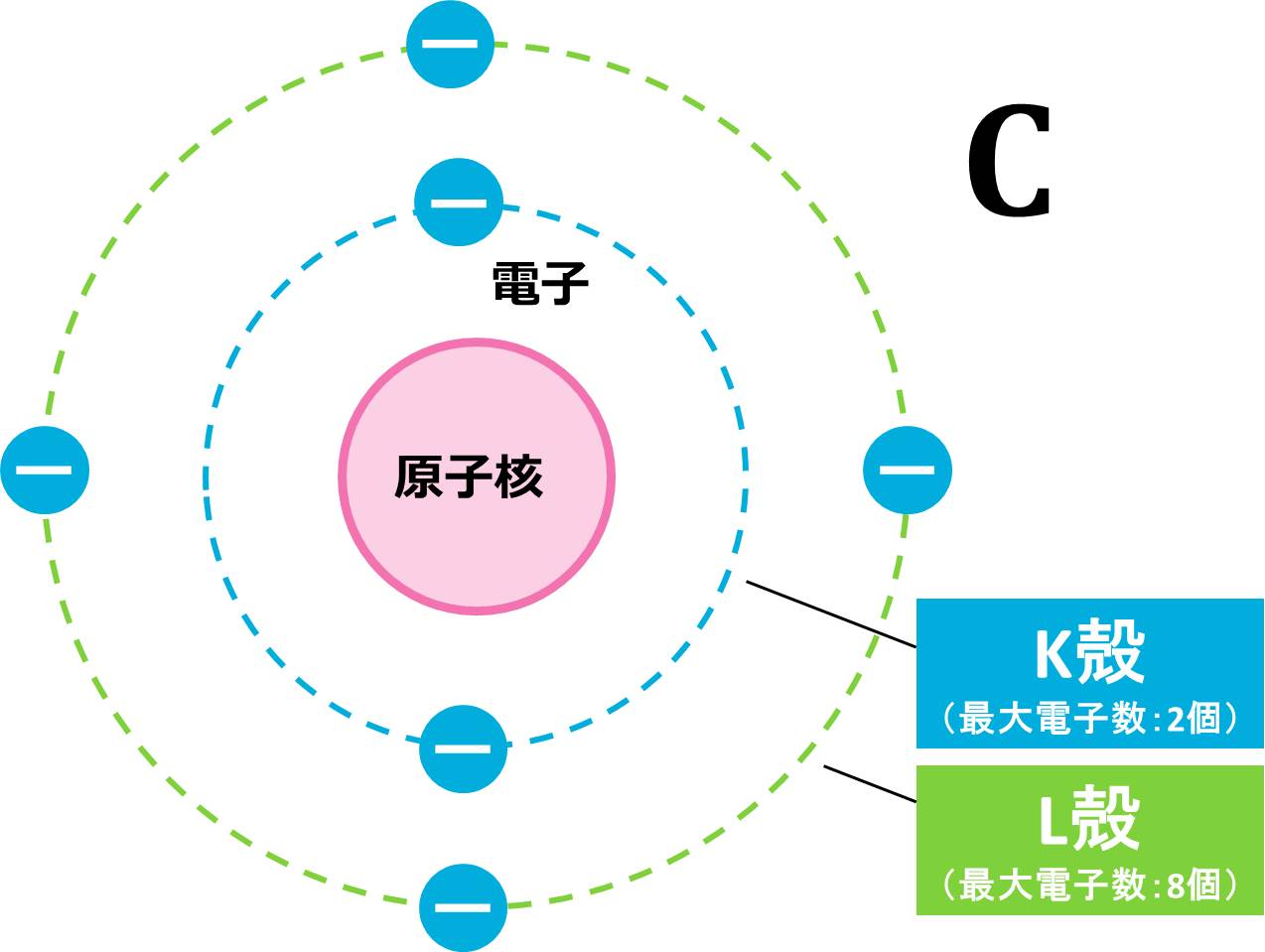
(a) まずは、電子の数を求めましょう。C(炭素)原子は原子番号が6なので、電子の数は6個です。(電子の数=原子番号)電子の数がわかったので、これらの6個の電子を内側の電子殻から配置していきます。
1番内側のK殻は最大電子数が2個なので、炭素原子が持つ6個の電子のうち、2個がK殻に配置されます。残りの電子は4個ですが、L殻の最大電子数は8個なので、残りは4個はすべてL殻に収まりそうです。
K殻に2つ、L殻に4つなので、例と同じ書き方をすると、C=K(2)L(4)となります。この配置を図で表すと下の図のようになります。このような図をイメージしながら電子配置を行ってください。
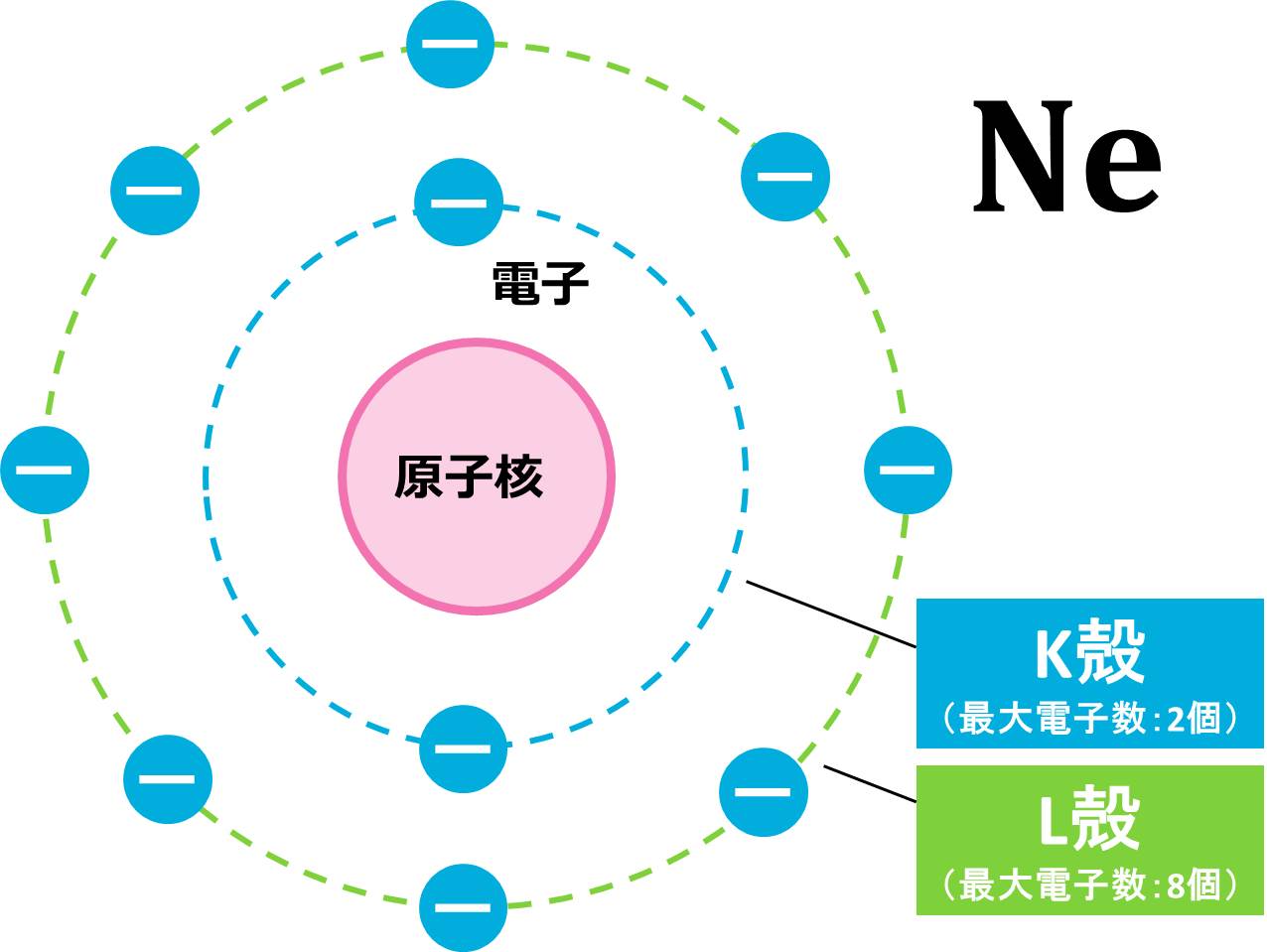
(b) まずは、電子の数を求めましょう。電子の数=原子番号なので、Ne(ネオン)原子の電子数は10個です。
電子の数がわかったので、これらの10個の電子を内側の電子殻から配置していきます。
1番内側のK殻は最大電子数が2個なので、Ne原子が持つ10個の電子のうち、2個がK殻に配置されます。残りの電子は8個ですが、L殻の最大電子数は8個なので、残り8個はL殻にピッタリ収まりそうです。
K殻に2つ、L殻に8つなので、例と同じ書き方をすると、Ne=K(2)L(8)となります。この配置を図で表すと下の図のようになります。このような図をイメージしながら電子配置を行ってください。
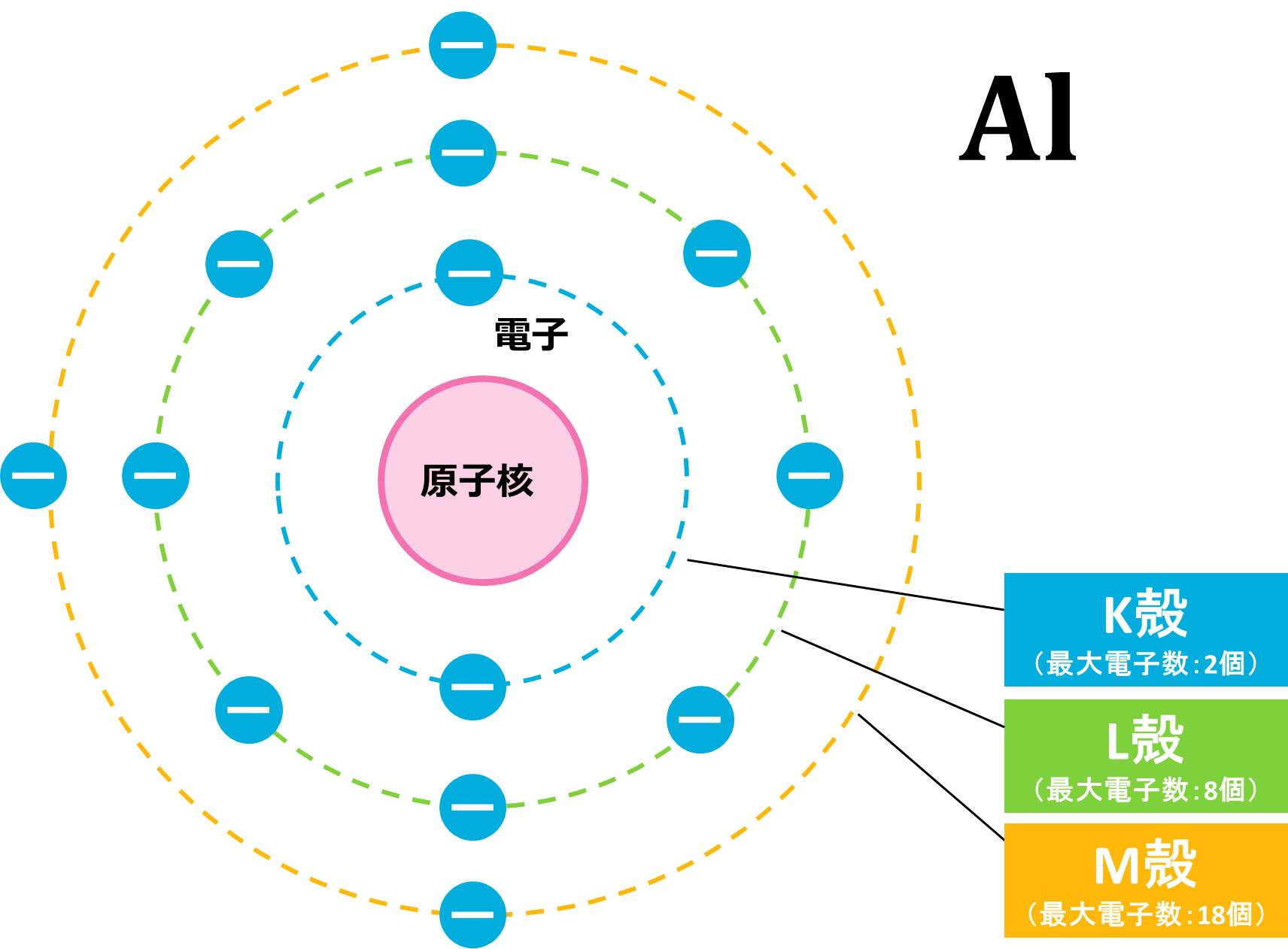
(c) まずは、電子の数を求めましょう。電子の数=原子番号なので、Al(アルミニウム)原子の電子数は13個です。
電子の数がわかったので、これらの13個の電子を内側の電子殻から配置していきます。
1番内側のK殻は最大電子数が2個なので、アルミニウム原子が持つ13個の電子のうち、2個がK殻に配置されます。残りの電子は11個ですが、L殻の最大電子数は8個なので、8個がL殻に入ったあと3個余ります。L殻にも入りきらなかった3個の電子は、3番目の電子殻であるM殻に入ります。
K殻に2つ、L殻に8つ、M殻に3つなので、例と同じ書き方をすると、Al=K(2)L(8)M(3)となります。この配置を図で表すと下の図のようになります。このような図をイメージしながら電子配置を行ってください。