スマホで化学!
高校化学を見やすく, 詳しく解説
原子の構造・表記
- 例題1
下の図は、ある原子の様子を表した図である。次の問いに答えよ。
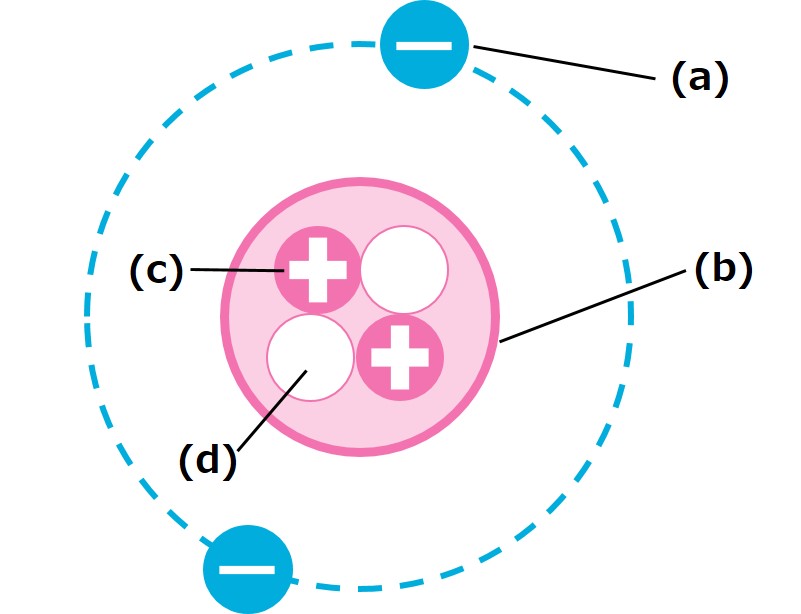 (1)図の(a)〜(d)の名前を答えよ。
(1)図の(a)〜(d)の名前を答えよ。
(2)この原子の原子番号を答えよ。
(3)この原子の質量数を答えよ。

(2)この原子の原子番号を答えよ。
(3)この原子の質量数を答えよ。
- (1)(a)電子(b)原子核(c)陽子(d)中性子
(2)2 (3)4
解説:
(1)原子の中心には原子核(b)があり、この周りをまわっているのが電子(a)です。原子核の中には、陽子と中性子が入っています。プラスの電気をもっている方が陽子(c)で、電気をもっていない方が中性子(d)です。
図を見てわかるように、原子核の中身は陽子(プラス)と中性子(電気0)なので、合計するとプラスの電気をもっていることになります。
そして、電子(マイナス)が陽子と同じ数だけ原子核の周りを回っているので、プラスとマイナスが打ち消されて、原子全体としては、プラマイゼロの中性の状態となっています。これはどんな原子でも同じです。
例えば、原子核に陽子が4つある原子ならば、その周りを4つの電子が回っていて、原子全体として見ればプラマイゼロの中性になるようになっています。
※電子は陽子と同じ数ですが、中性子の数は陽子の数と同じとは限らないので注意です。
(2)
原子核に入っている陽子の数を原子番号といいます。この問題の図では陽子が2つなので原子番号は2です。
また、(1)の解説で書いた通り、陽子の数と電子の数は同じなので、原子番号は電子の数ともいえます。もう少し後にやりますが、元素の周期表では、番号が1つ増えるごとに陽子と電子の数が1つずつ多くなっていきます。
Point!
原子番号 = 陽子の数 = 電子の数(3)
原子の重さを知るための目安として質量数というものが使われます。考え方は単純で、「原子に含まれる粒(陽子と中性子)の数の合計で、だいたいの重さがわかるでしょ」というものです。
なぜ、電子の数は足さないかというと、電子の質量は非常に軽くて、陽子や中性子の質量の1840分の1程度だからです。そんなに軽いなら、あってもなくても変わらないので、質量の計算には入れなくてOKですね。
Point!
質量数 = 陽子の数 + 中性子の数この問題では、陽子が2つ、中性子が2つ書かれているので、質量数= 2 + 2 = 4 です。