スマホで化学!
高校化学を見やすく, 詳しく解説
イオン式
- 例題1
次の①〜④のイオン式を答えよ。
①水素イオン
②硫酸イオン
③酢酸イオン
④亜鉛イオン
①水素イオン
②硫酸イオン
③酢酸イオン
④亜鉛イオン
- ①H+ ②SO42- ③CH3COO- ④Zn2+
解説:
下の表にあるイオンは覚えておきましょう。 表に出てくるO2-やNa+のように、元素記号の後に小さく「-」や「+」を付けたものをイオン式と呼びます。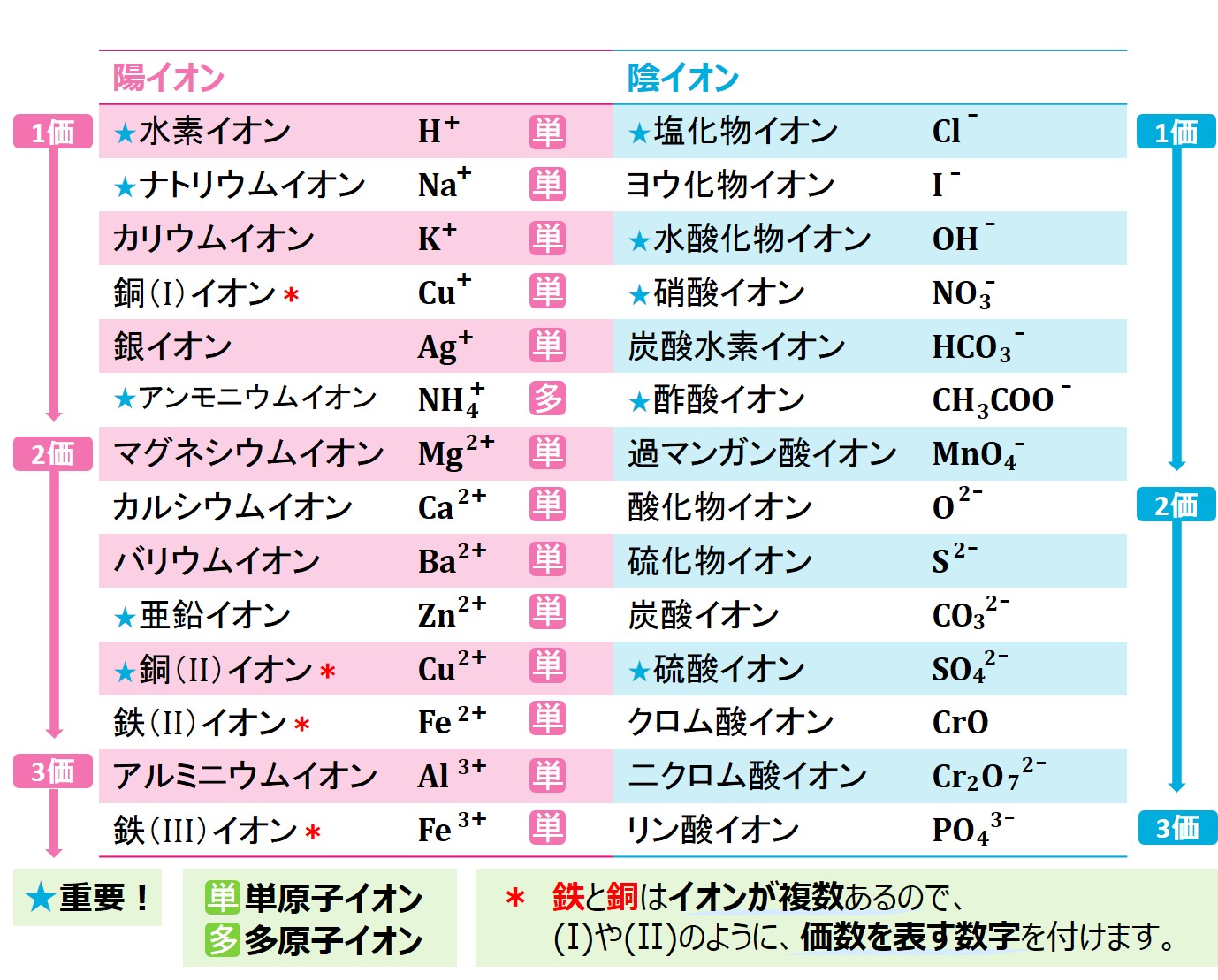
イオンにはプラスの電気をもった陽イオンとマイナスの電気をもった陰イオンがあります。
※詳しくはこのページの下の方にある補足へ。
表のように、いくつものイオンが存在しますが、その中でも、Cl-やCa2+のように、1つの原子からできているイオンを単原子イオンと呼びます。また、NH4+のようにいくつかの原子(この場合、NとH)がくっついているものを多原子イオンと呼びます。
英語で人の名前を書くときと一緒で、原子の最初の文字は大文字にするというルールがあるので、大文字が2つ以上あれば、2つ以上の原子が含まれていることになり、多原子イオンです。
また、「-」や「+」の前の数字を価数といいます。例えば、「Al3+」ならば3価です。「Cl-」のように数字がない場合は、1が省略されているので1価です。
【補足】陰イオンと陽イオン
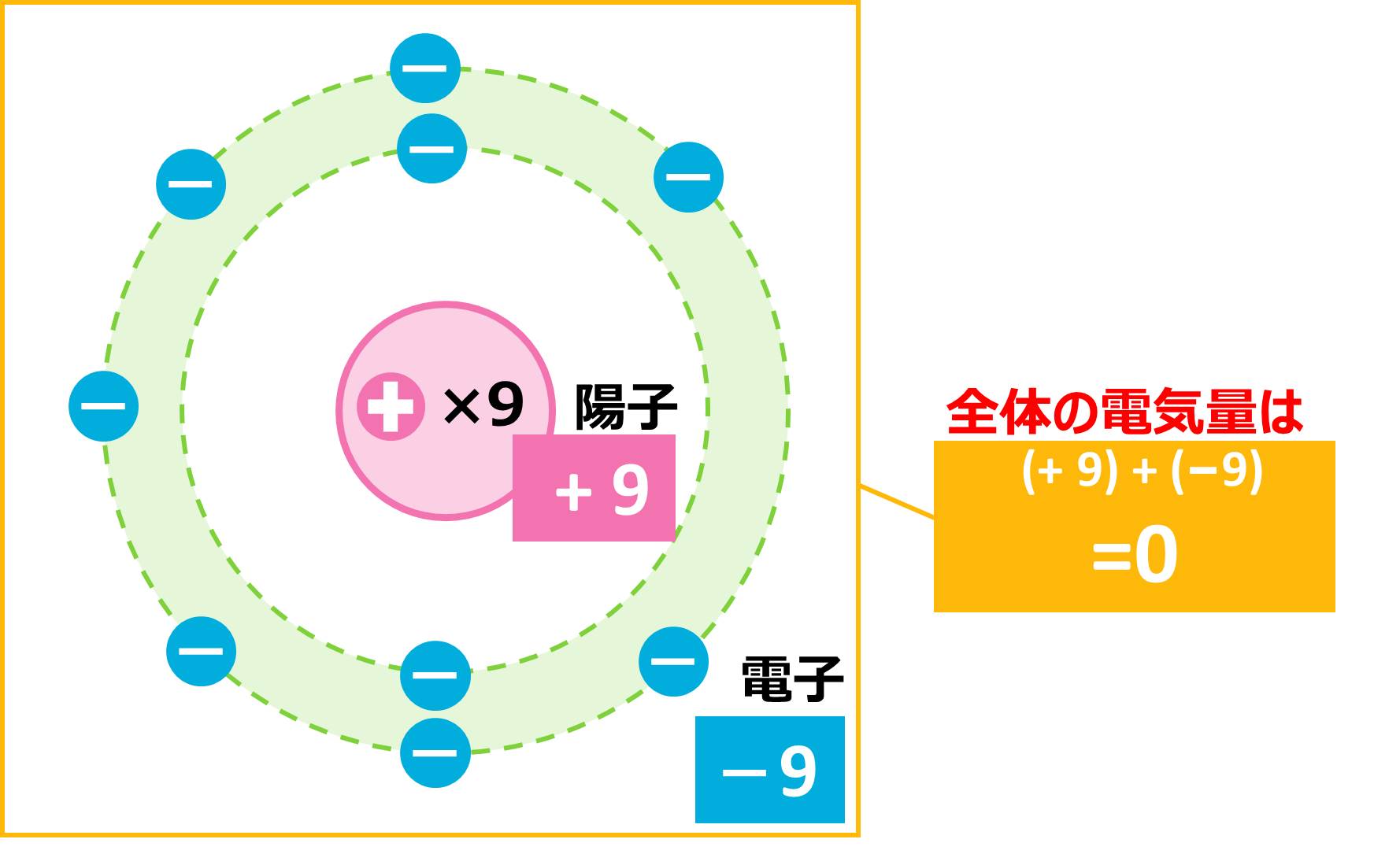
1つ前の単元でやりましたが、 原子がイオンになる時には、原子番号が1番近い貴ガス(希ガス)と同じ電子配置になるように、電子を渡したり、もらってきたりするのでしたね。ここでは、こうしてできたイオンの種類について考えていきましょう。原子の状態では、必ず、陽子の数=電子の数となっています。例えば、フッ素は原子番号9番なので、陽子と電子を9個ずつもっています。このとき、原子全体としては、下の図のようにプラスとマイナスがちょうど打ち消し合い、電気をもたない中性の状態になっています。
フッ素の場合には、1番近い貴ガス(希ガス)が原子番号10のNe(※電子の数=原子番号より、Neの電子数は10個)なので、あと1つ電子を外部からもらってくることで、イオンになります。すると、下の図のように、電子の数の方が多くなり、全体としてはマイナスの電気をもつようになります。
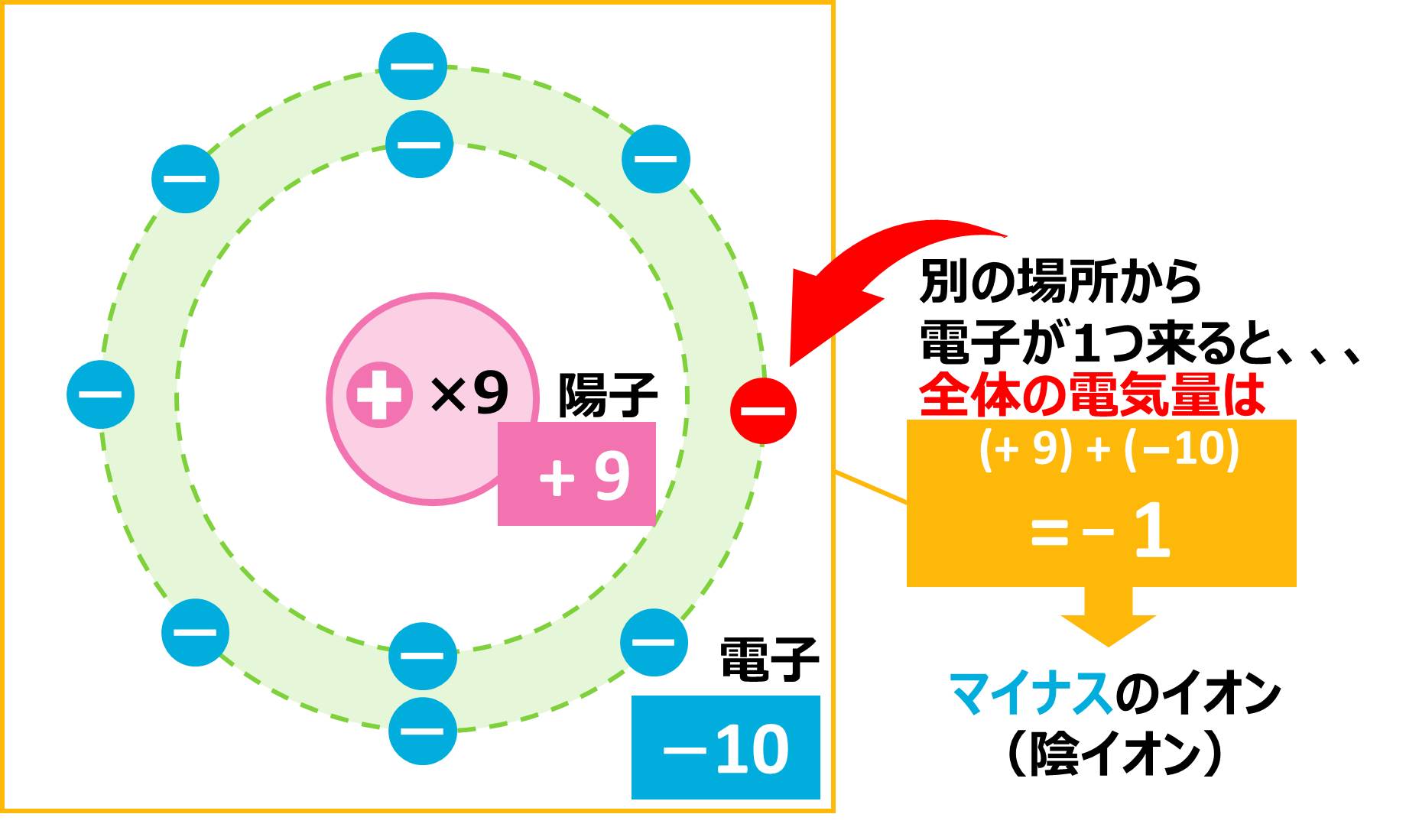
このように、電子の数が増えたことで全体で見たときにマイナスの電気をもったものを陰イオンと言います。「陰」とは「マイナス」という意味です。つまり、陰イオン=マイナスの電気をもつイオンです。
次に、ナトリウムNaのイオンについて考えてみましょう。 ナトリウムは原子番号11番なので、陽子と電子を11個ずつもっています。このとき、原子全体としては、下の図のようにプラスとマイナスがちょうど打ち消し合い、電気をもたない中性の状態になっています。
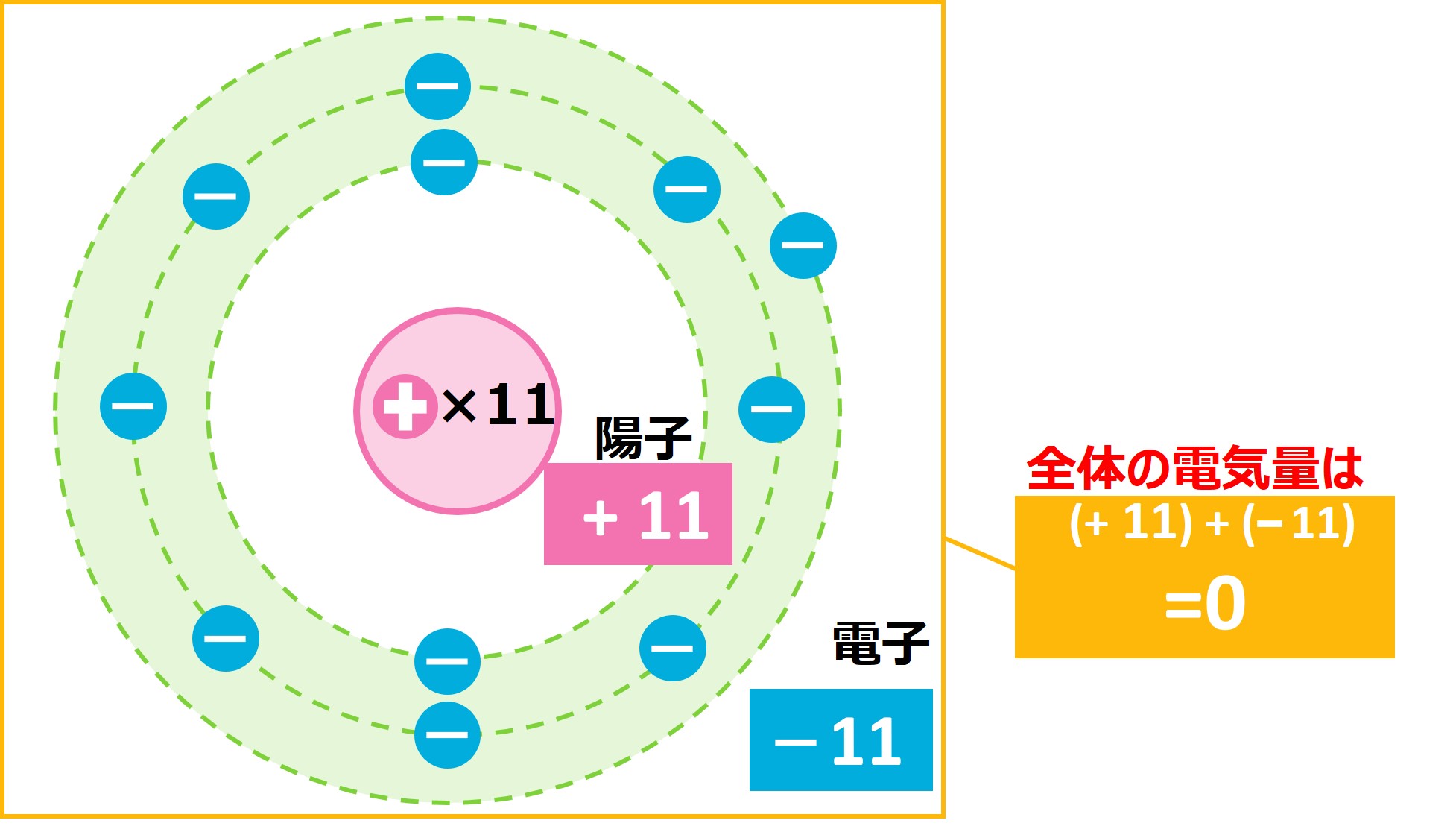
ナトリウムの場合、1番近い貴ガス(希ガス)が原子番号10のNe(※電子の数=原子番号より、Neの電子数は10個)なので、電子を1つ外部に渡すことで、イオンになります。すると、下の図のように、陽子の数の方が多くなり、全体としてはプラスの電気をもつようになります。

このように、電子の数が減ったことで全体で見たときにプラスの電気をもったものを陽イオンと言います。「陽」とは「プラス」という意味です。つまり、陽イオン=プラスの電気をもつイオンです。
間違えやすいのですが、プラスのイオンだからといって、陽子をもらってくるわけではありません。
陽子というのは中心の原子核の中に閉じ込められているので、簡単に渡したりもらったりできません。変化するのはあくまで電子だけで、電子が増えればマイナスのイオン、電子が減ればプラスのイオンになります。