スマホで化学!
高校化学を見やすく, 詳しく解説
イオンの電子配置
- 例題1
フッ素FがイオンF-になった時、これと同じ電子配置の原子を答えよ。
- Ne(ネオン)
イオンの電子配置
「イオンの電子配置」と言われたら、原子番号が1番近い貴ガス(希ガス)と同じと覚えておいてください。(詳しい理由は下の補足へ。)Point!
イオンの電子配置 は、原子番号が1番近い 貴ガス(希ガス)と同じ
貴ガス(希ガス)とは、次の6つでしたね。
He(ヘリウム)、Ne(ネオン)、
Ar(アルゴン)、Kr(クリプトン)、
Xe(キセノン)、Rn(ラドン)
解説:
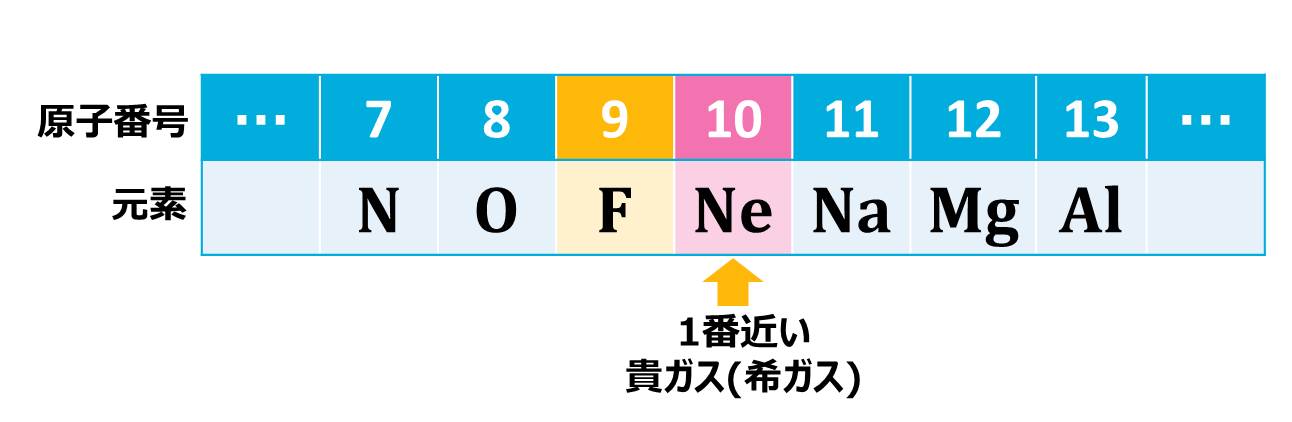
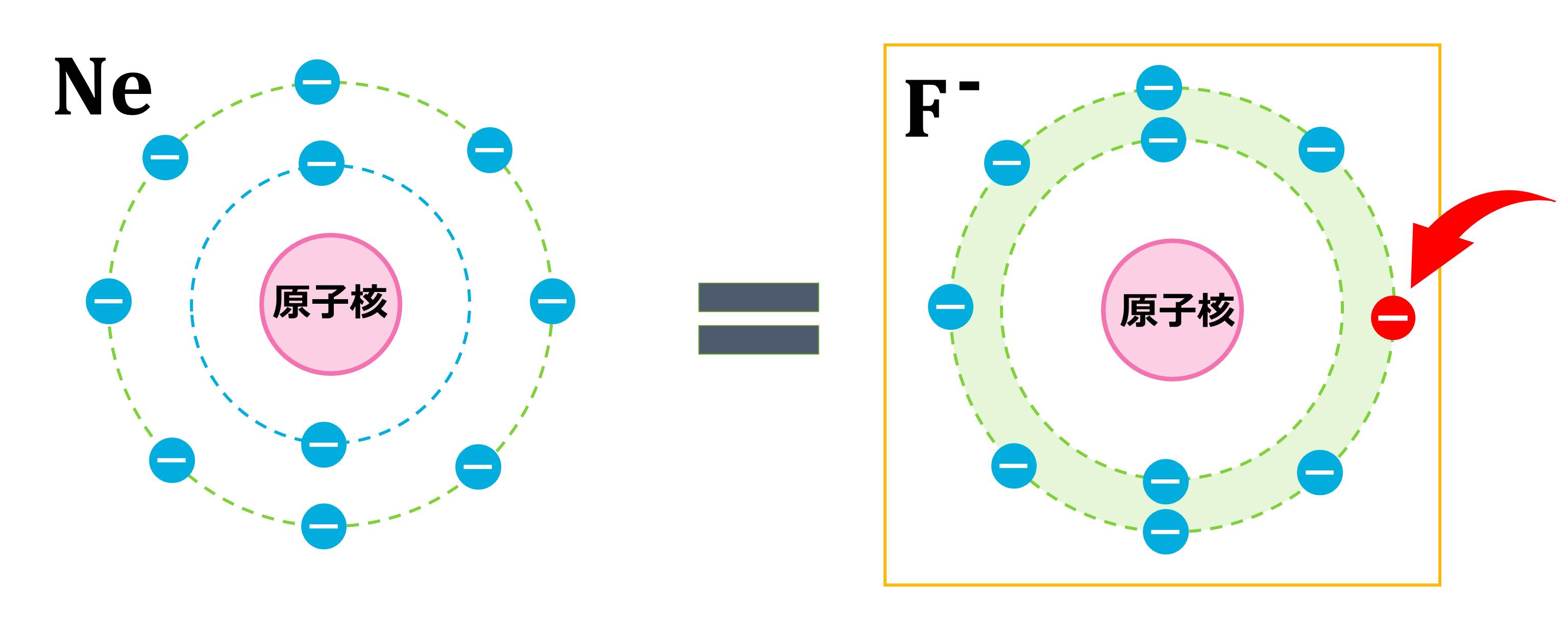
上のPoint!でやったように、イオンになった時の電子配置は、原子番号が1番近い貴ガス(希ガス)と同じになります。この問題に出てきたフッ素Fの原子番号は9番なので、原子番号が一番近い貴ガス(希ガス)は10番のネオンNeです。したがって、フッ素FがイオンになったF-はNeと同じ電子配置です。
【補足】イオンのでき方
では、なぜ「イオンになった時の電子配置は、原子番号が1番近い貴ガス(希ガス)と同じ」になるのでしょうか。それは、イオンになる前の元の状態の電子配置をみればわかります。例題のフッ素Fの電子配置は下の図のようになります。(電子配置についての詳しい説明はこちら)
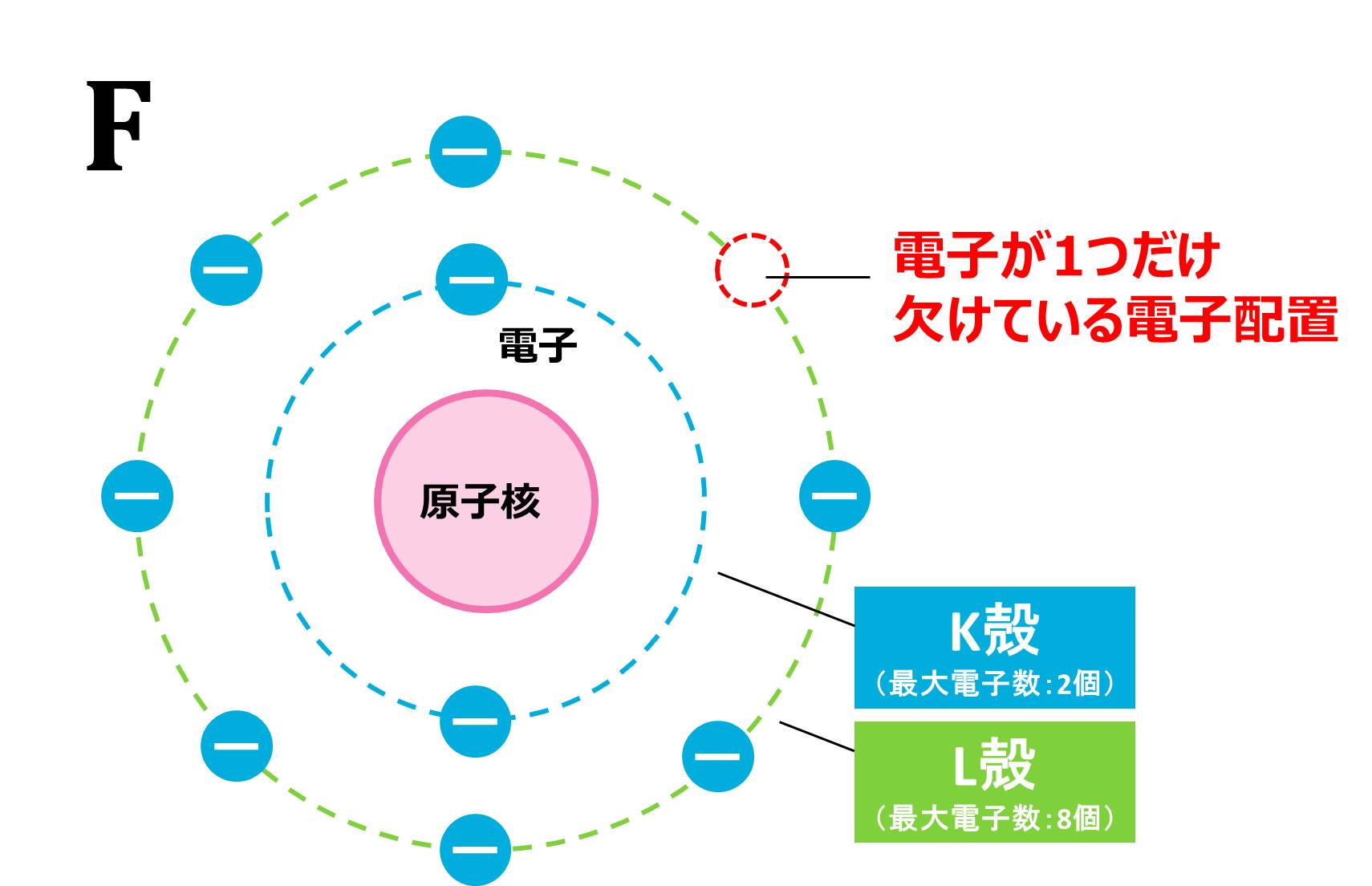
右上にあと1つ電子をもってくれば、ちょうど、キリの良いきれいな電子配置になりますね。そこで電子をあと1つ外部からもらってきて、きれいな電子配置になろうとします。
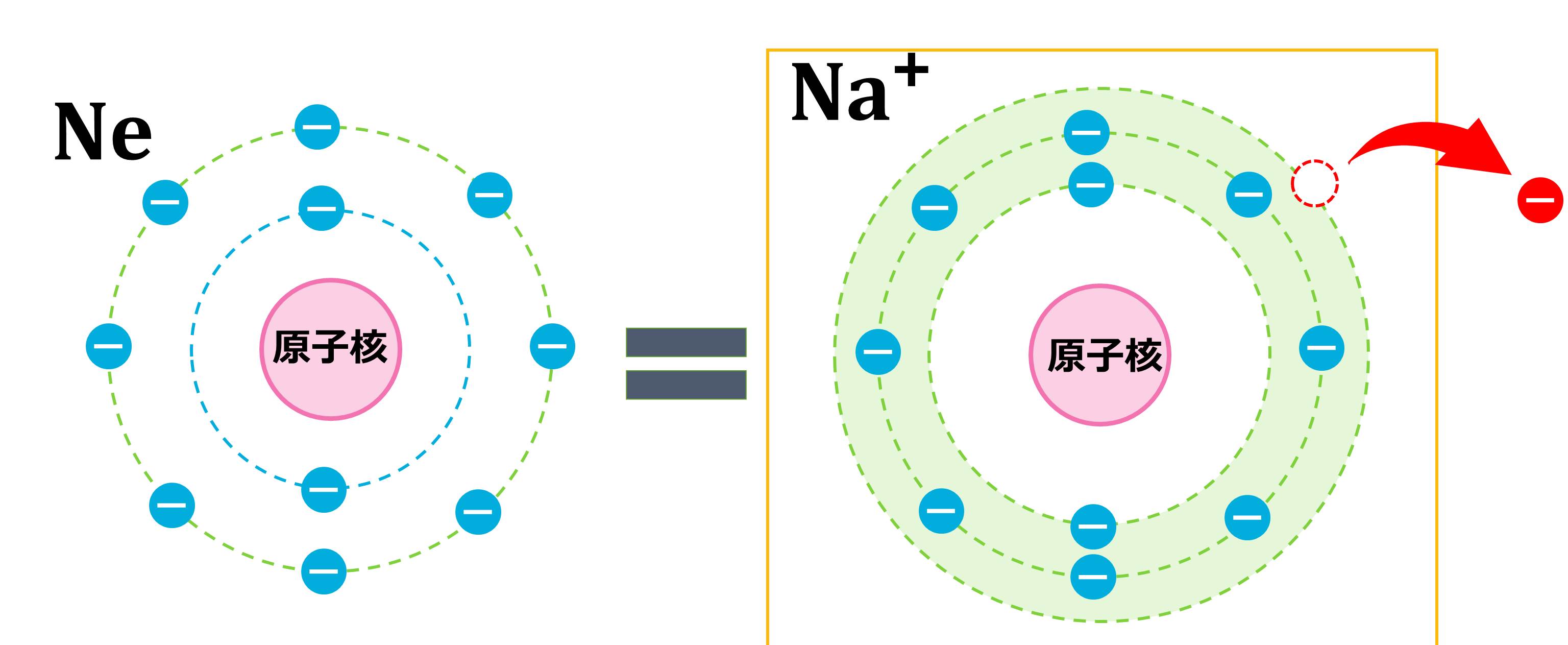
電子を1つもらうと電子数は10個になるので、原子番号10番のNeと同じ電子配置となるわけです。
(※電子の数=原子番号なので、もとから電子を10個持っている原子は原子番号10番のNeです。)
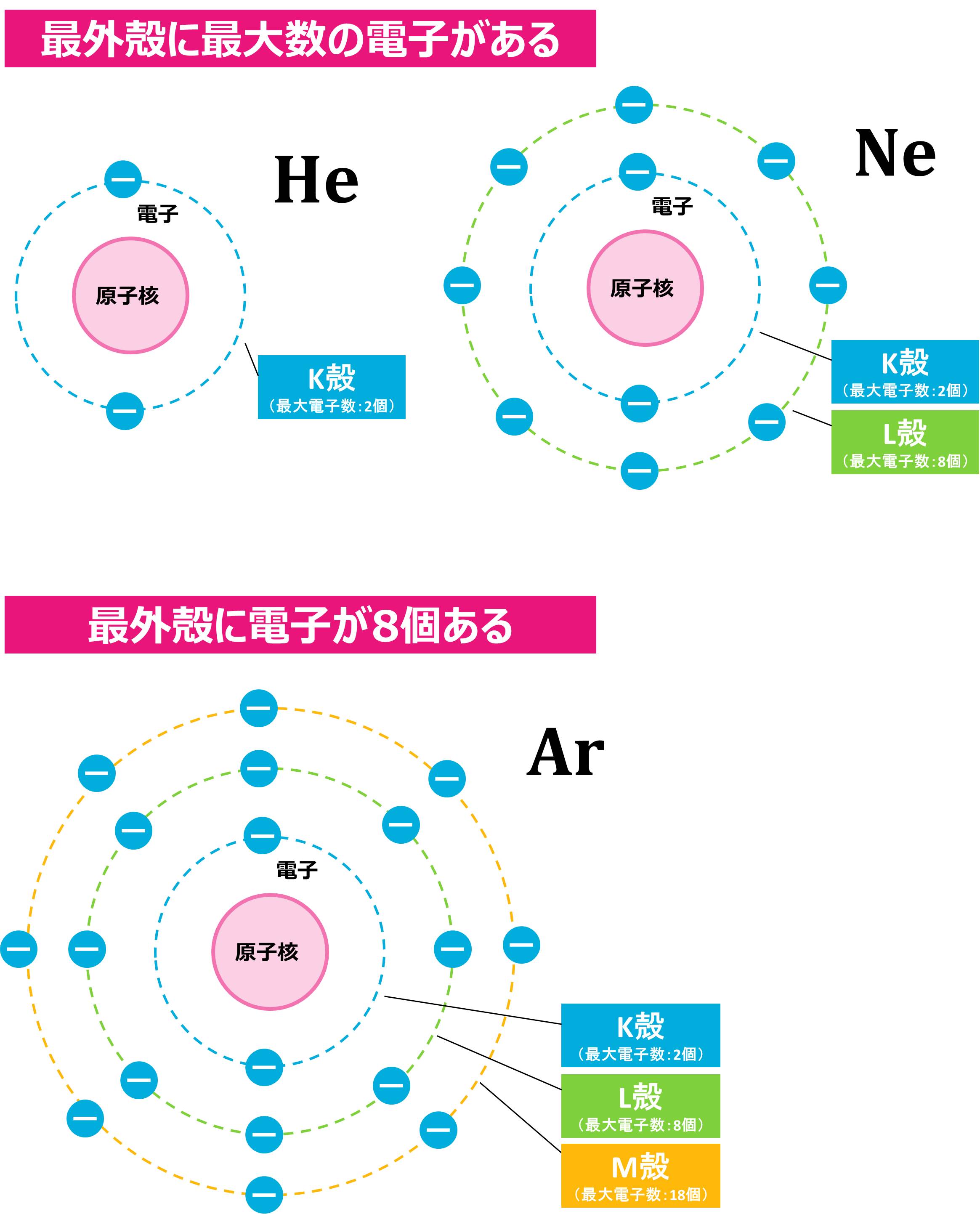
「キリの良いきれいな電子配置」というのは、具体的には、最外殻に最大数の電子が入った状態、または、最外殻電子が8個の状態のことです。
そして、この条件を満たすのが貴ガス(希ガス)なのです。 Ne以外の貴ガス(希ガス)も下の図のように、キリの良いきれいな電子配置をしています。 そのため、どの原子もイオンになる時には、自分に1番近い貴ガス(希ガス)と同じ電子配置になれるように、電子の数を調整するのです。
貴ガス(希ガス)がみんなの憧れで、みんながそれぞれ、自分に一番近い貴ガス(希ガス)を目指すというイメージです。
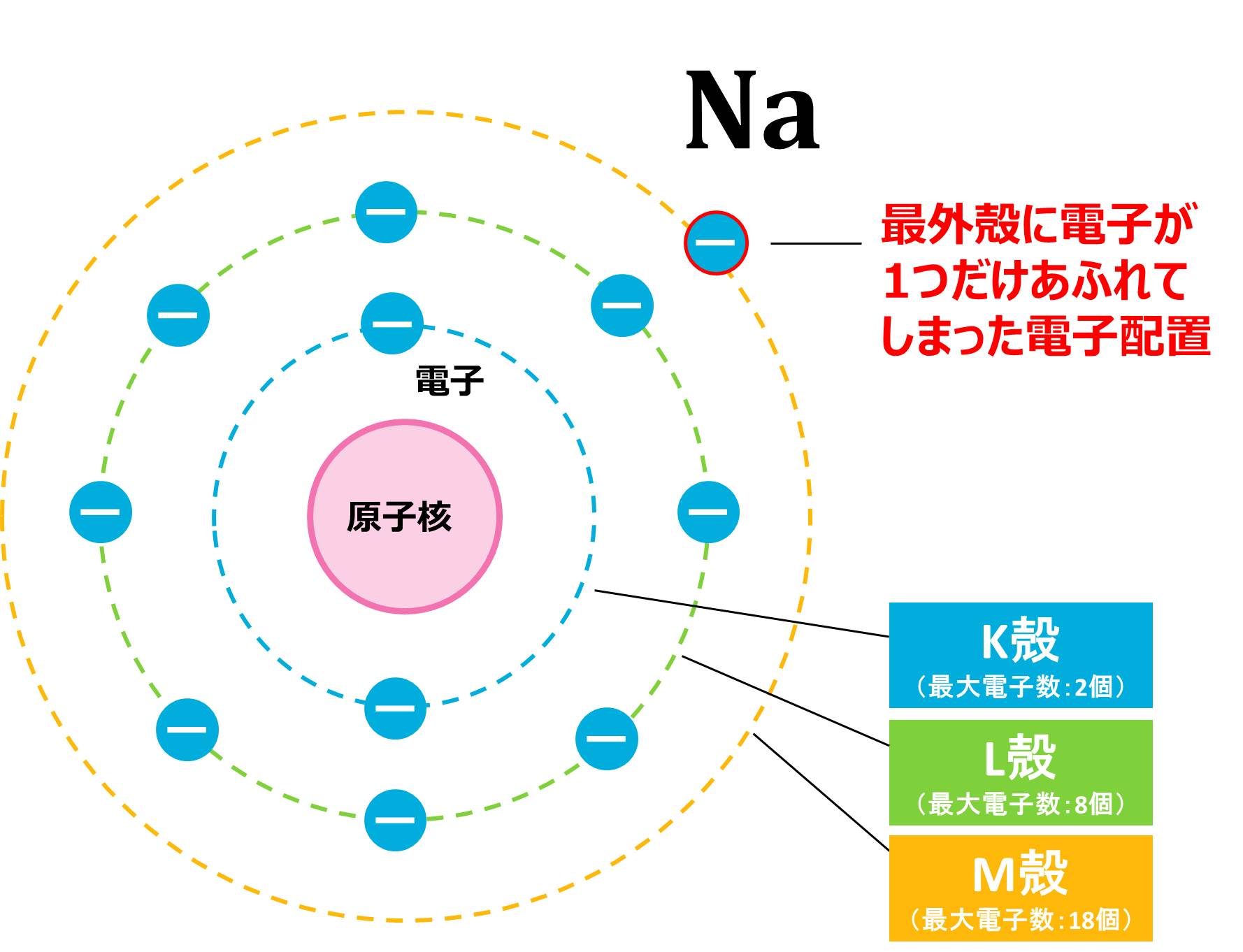
フッ素Fの場合はイオンになる時に外部から電子をもらってきましたが、その逆で、外部に電子を渡してイオンになるものもあります。 それは、ナトリウムNaのように、貴ガス(希ガス)よりも電子が少し多い場合です。
Naは原子番号が11番なので、電子を11個もっています。電子配置は、下の図のように、最外殻に1つだけ電子があり、キリが良いとは言えません。
原子番号11番のNaに1番近い貴ガス(希ガス)は原子番号10番のNeです。
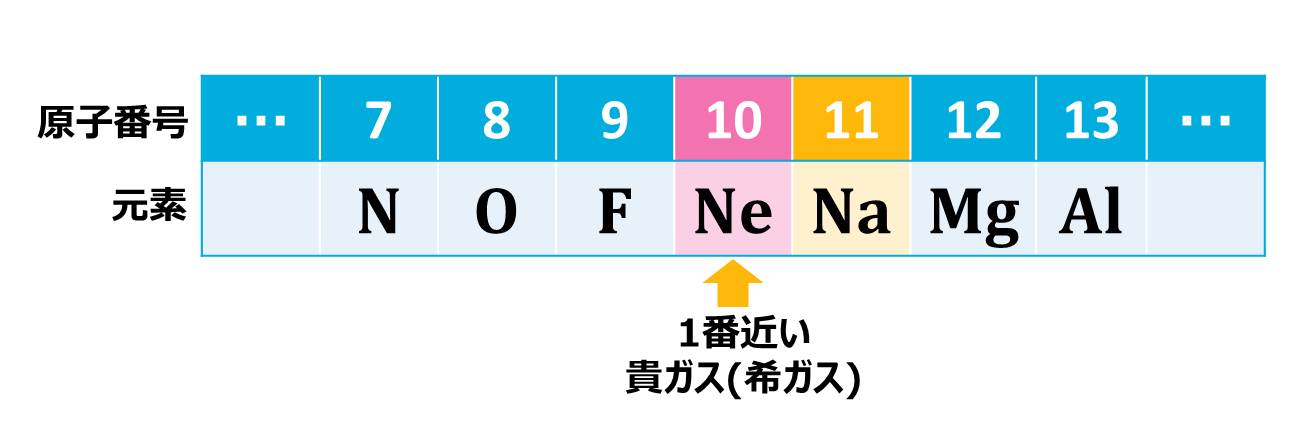
原子番号=電子数ですので、Na(原子番号11)がNe(原子番号10)と同じ電子配置になるためには、電子を1つ外部に置いてくる必要があります。こうすることで、Neと同じ、きれいな配置になります。