スマホで化学!
高校化学を見やすく, 詳しく解説
最外殻電子と価電子
- 練習2
原子番号が10番のネオンNeについて、次の問いに答えよ。
(1) 最外殻電子の数はいくつか。
(2) Neの価電子数はいくつか。
(1) 最外殻電子の数はいくつか。
(2) Neの価電子数はいくつか。
- (1) 8個 (2) 0個
解説:
(1) 最外殻電子の数は、電子配置を書くことで求められます。そのために、まず、Neの電子の数を求めましょう。原子番号が17なので、電子の数は17個です(電子の数=原子番号)。次に電子配置です。内側の電子殻から順に10個の原子を配置していきます。
1番内側のK殻は最大電子数が2個なので、Ne原子が持つ10個の電子のうち、2個がK殻に配置されます。残りの電子は8個です。L殻の最大電子数も8個なので、残り全てがちょうどL殻に入りきりそうです。
電子配置を見ると、1番外側のL殻には電子が8個あるので、最外殻電子(1番外側にある電子の数)は8個です。
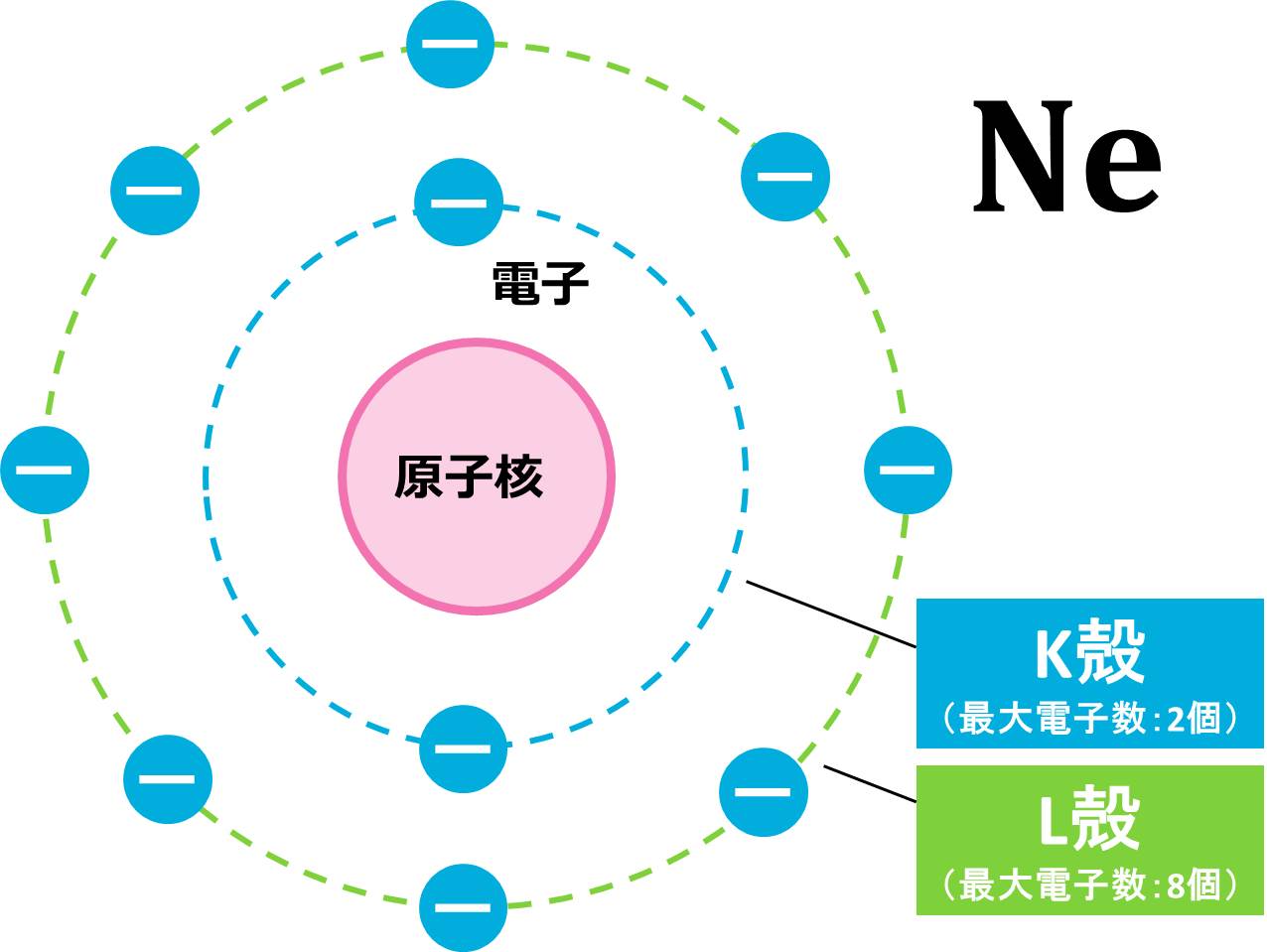
(2) Neのように最外殻電子数が8個の時には、特別ルールにより価電子の数は0個となります。
Point!
価電子数と最外殻電子数は基本的に同じ数!ただし、、、
◆最外殻に空きがないとき
◆最外殻電子数が8個のとき
には、価電子数を0とする
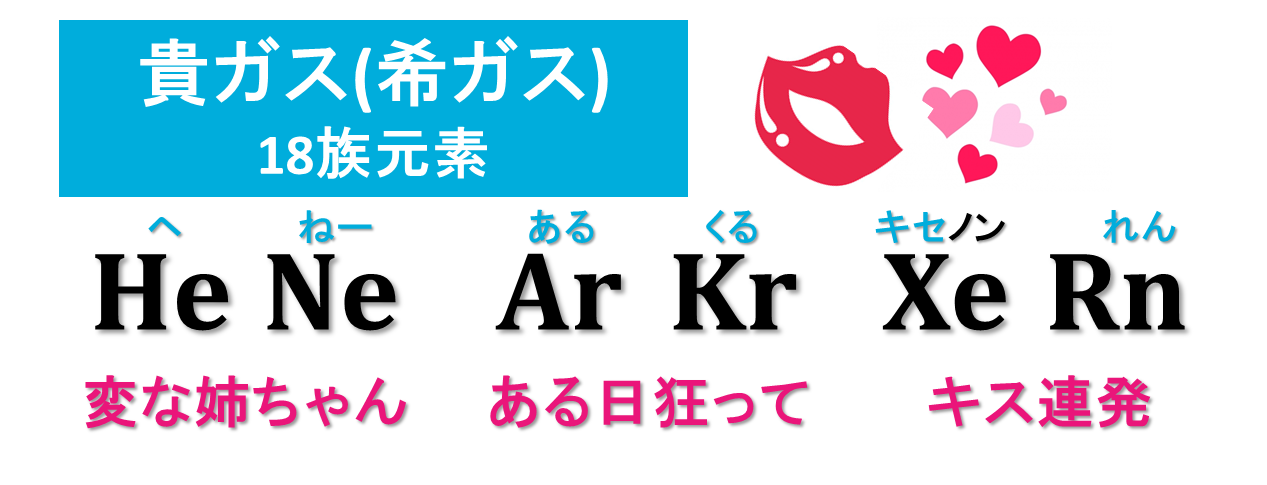
◆少し先の単元でやりますが、
「He(ヘリウム), Ne(ネオン), Ar(アルゴン),
Kr(クリプトン), Xe(キセノン), Rn(ラドン)」
の6つは貴ガス(希ガス)と呼ばれており、どれも価電子数が0です。
覚えおけば、電子配置を書かなくても、「Arだから価電子は0」とすぐにわかります。どうせ覚えることになるので、いま覚えてしまってもいいかもしれません。
この問題は
飛ばす
飛ばす
次の問題に
すすむ!
すすむ!