スマホで化学!
高校化学を見やすく, 詳しく解説
電子配置
- 練習1
次の(a)〜(c)の原子の電子配置を下に示した[例]のような形で表せ。
[例] F(原子番号:9) ⇒ F=K(2)L(7)
(a) Si(原子番号:14) (b) O(原子番号:8)
(c) Ar(原子番号:18)
[例] F(原子番号:9) ⇒ F=K(2)L(7)
(a) Si(原子番号:14) (b) O(原子番号:8)
(c) Ar(原子番号:18)
- (a)Si=K(2)L(8)M(4) (b)O=K(2)L(6) (c)Ar=K(2)L(8)M(8)
電子配置のやり方
これは、電子配置を求める問題です。電子が原子核の周りをまわるコースを電子殻といい、内側から順にK殻、L殻、M殻、N殻、・・・と、Kから始まるアルファベット順に名前があります。そして、1番目のK殻は2個、2番目のM殻は8個、3番目のL殻は18個までというように、入ることのできる電子の数に制限があり、内側の電子殻から順に電子が配置されていきます。
この数字は覚えなくても、「n番目の電子殻には2n2個まで」という公式のnに数字を代入すれば求められます。

解説:
(a) 電子の数=原子番号なので、Si(ケイ素)原子の電子数は14個です。K殻は最大電子数が2個なので、Si原子が持つ14個の電子のうち、2個がK殻に配置されます。残りの電子は12個ですが、L殻の最大電子数は8個なので、8個がL殻に入ったあとに4個余ります。この4個の電子はM殻に入ります。K殻に2つ、L殻に8つ、M殻に4つなので、例と同じ書き方をすると、Si=K(2)L(8)M(4)となります。この配置を図で表すと下の図のようになります。
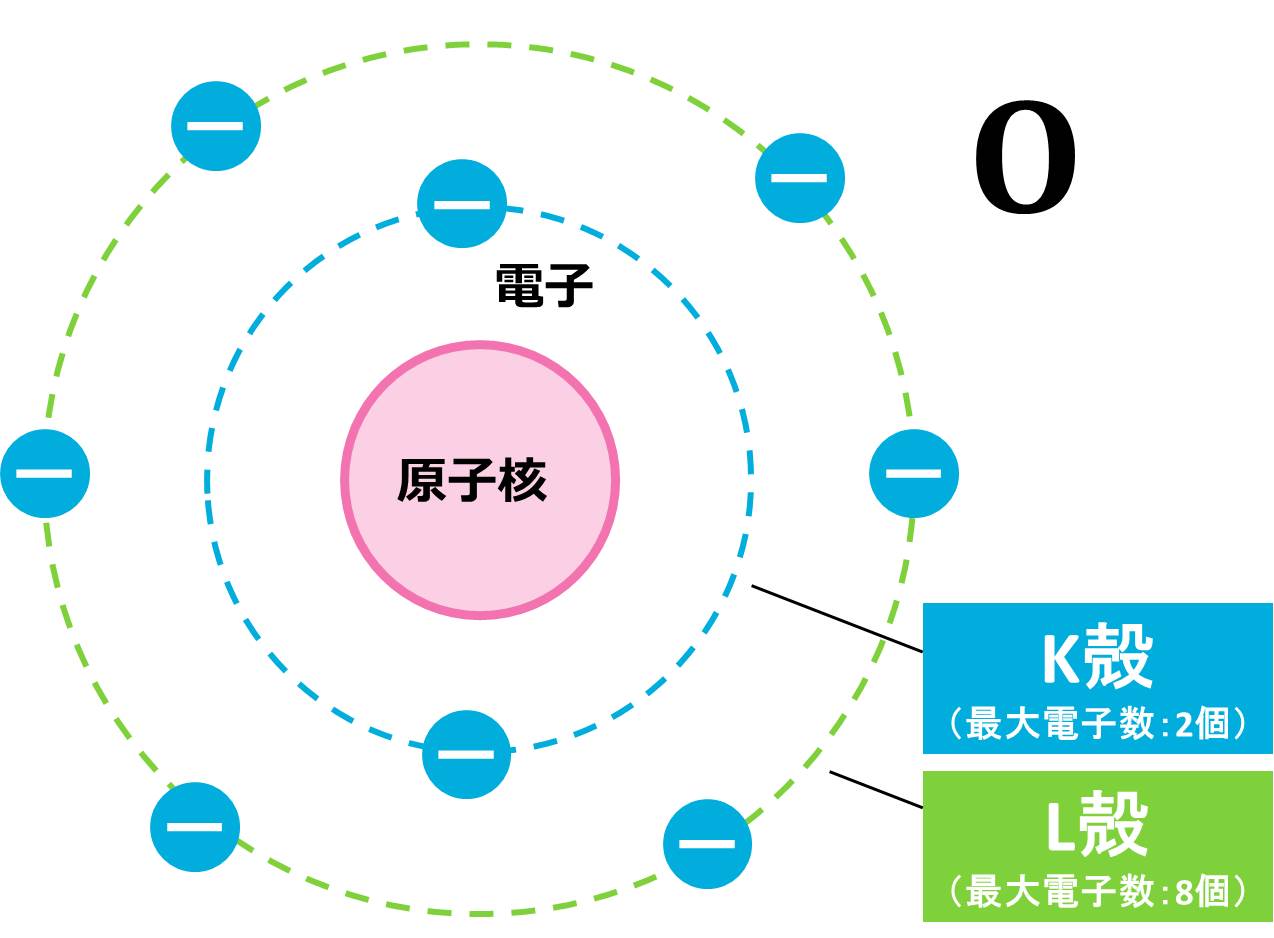
(b) O(酸素)原子は原子番号が8なので、電子の数は8個です(電子の数=原子番号)。K殻は最大電子数が2個なので、酸素原子が持つ8個の電子のうち、2個がK殻に配置されます。残りの電子は6個ですが、L殻の最大電子数は8個なので、残りはすべてL殻に収まりそうです。K殻に2つ、L殻に6つなので、例と同じ書き方をすると、O=K(2)L(6)となります。この配置を図で表すと下の図のようになります。
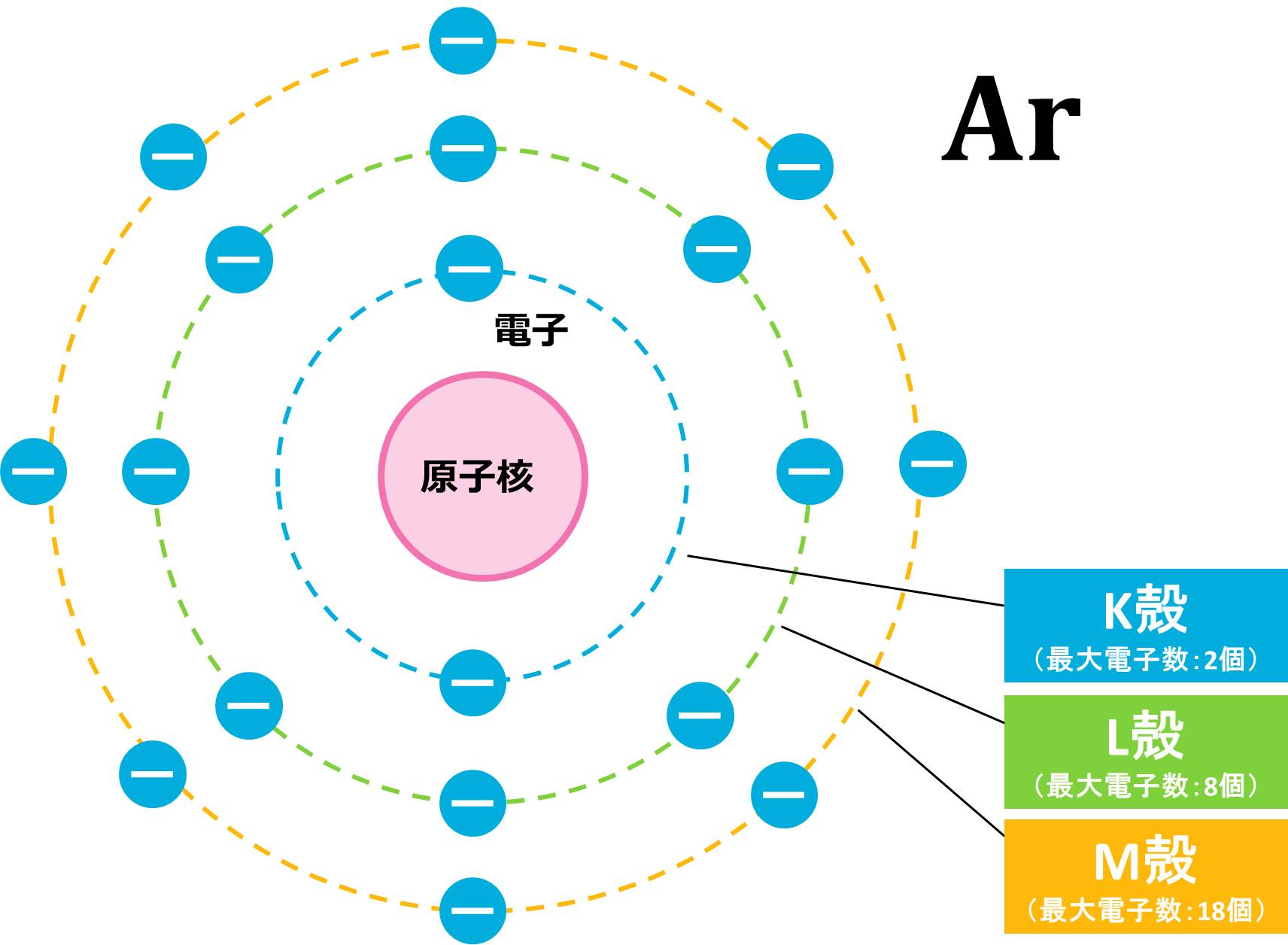
(c) 電子の数=原子番号なので、Ar(アルゴン)原子の電子数は18個です。K殻は最大電子数が2個なので、Ar原子が持つ18個の電子のうち、2個がK殻に配置されます。残りの電子は16個ですが、L殻の最大電子数は8個なので、8個がL殻に入ったあとに電子は8個余ります。この8個の電子をM殻に入れれば完了です。K殻に2つ、L殻に8つ、M殻に8つなので、例と同じ書き方をすると、Ar=K(2)L(8)M(8)となります。この配置を図で表すと下の図のようになります。