スマホで化学!
高校化学を見やすく, 詳しく解説
電子式
- 練習2
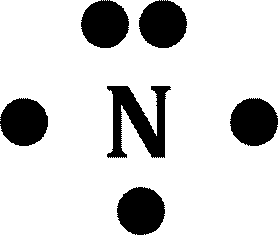
原子番号が7番のN(窒素)を電子式で表せ。
電子式の書き方
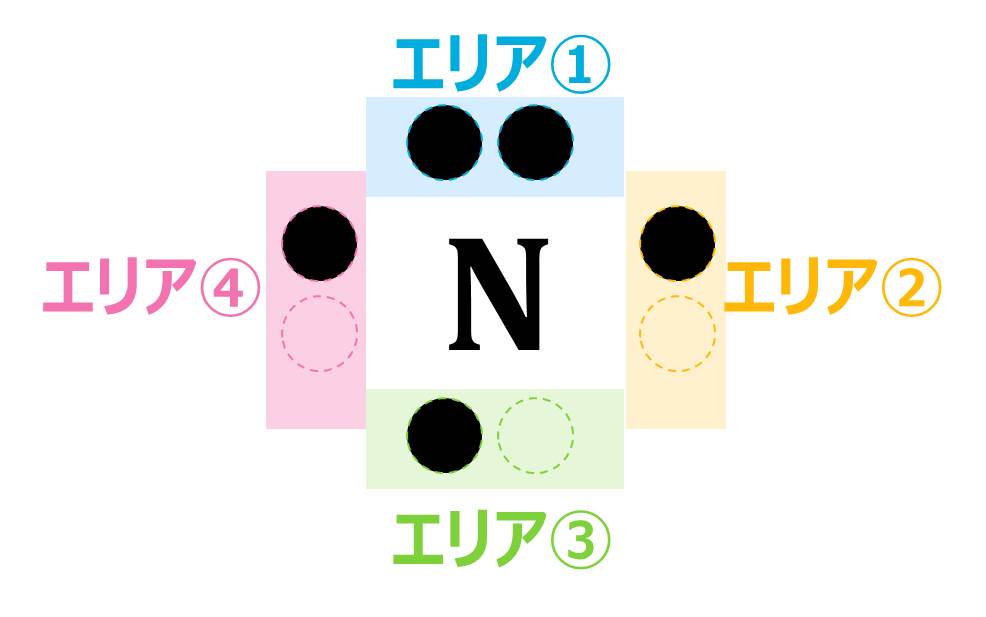
電子式とは、最外殻電子を「●」で表したものです。「●」をかけるエリアは下の図のように決まっていて、ここに最外殻電子の数だけ「●」を書き入れていきます。
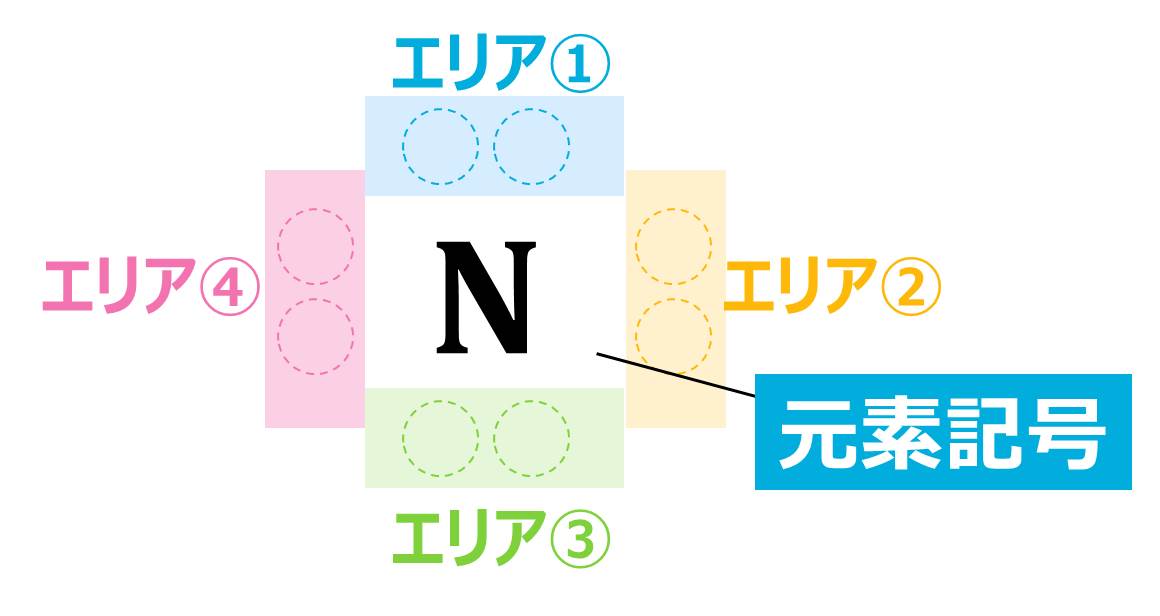
電子式を書くのはそんなに難しくありません。次の3つのルールにしたがって「●」をかけばOKです。
Point!
電子式を書くときのルール①4つ目までは各エリアに1つずつ「●」を書いていく
※「●」を書く順番や位置に決まりはありません
②1つのエリアに書ける「●」は2つまで
③He(最外殻電子2つ)だけは、2つの「●」を同じエリアに書く(書くのはどのエリアでもOK)
解説:
それでは、N原子の電子式を考えましょう。電子式とは、最外殻電子を「●」で表したものでしたので、まずは電子配置を考えて、最外殻電子の数を求めなければなりません。
原子番号が7なので、電子の数は7個です(電子の数=原子番号)。この7個の電子を内側の電子殻から順に配置していきます。
K殻は最大電子数が2個なので、N原子が持つ7個の電子のうち、2個がK殻に配置されます。残りの電子は5個ですが、L殻の最大電子数が8個なので、残りは全てL殻に入りきります。
この場合、一番外側にあるのはL殻で、そこには電子が5個あるので、最外殻電子は5個です。なので、電子式を書く場合には、元素記号Nの周りに「●」を5つ書きます。
最初にPoint!で説明したように「4つ目までは各エリアに1つずつ「●」を書いていく」というルールがあったので、まずは各エリアに1つずつ「●」を書きます。
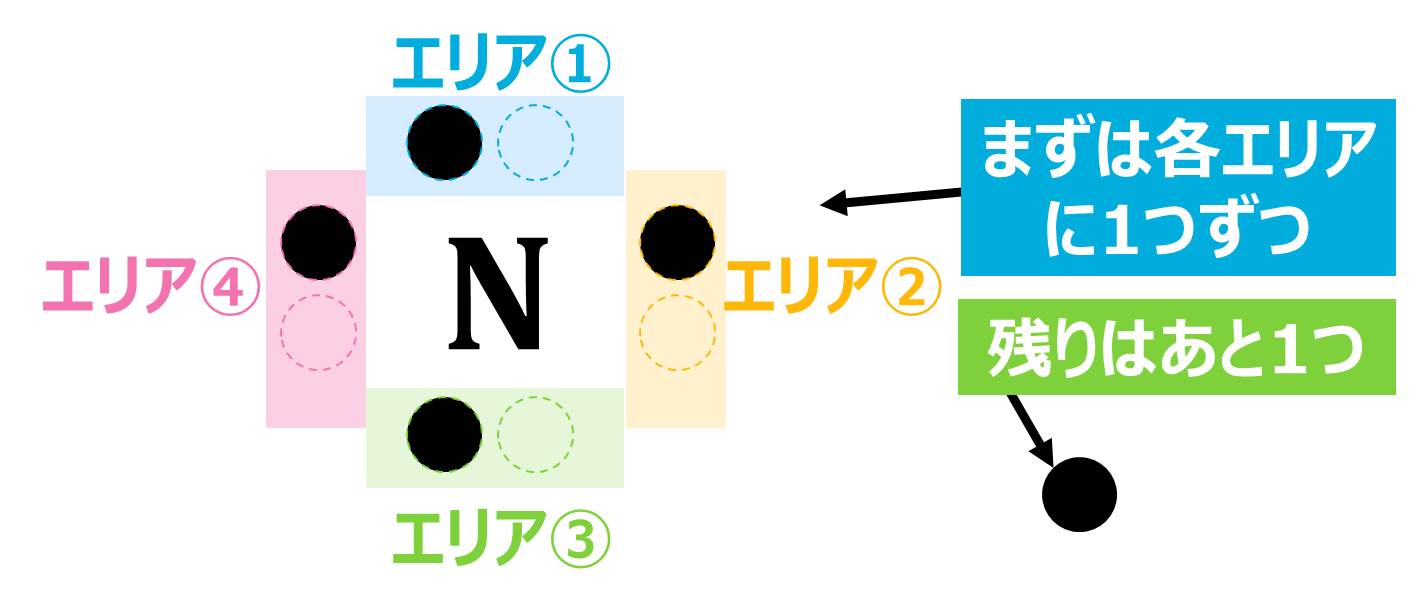
あと1つ書かなければいけないので、上のエリアに1つ書いて完成です。
(「●」の位置に決まりはないので、上ではなくても大丈夫です。)